5月29日,生命科学学院刘亮教授课题组在Nature biotechnology在线发表了题为“Trans-nuclease activity of Cas9 activated by DNA or RNA target binding”的研究论文,首次揭示了tracrRNA(trans-activating crRNA)与crRNA结合形成的gRNA(guide RNA)引导的Cas9在特异性地识别目标DNA或RNA分子后对非目标核酸分子(可以是DNA或RNA)展现出高效的反式切割活性。根据该特性,刘亮团队开发了基于Cas9反式切割活性的新型核酸检测平台,实现了对多种病毒和肿瘤耐药性突变的高灵敏度和特异性的检测。

基于CRISPR-Cas系统新型核酸酶活性的挖掘,是基因操作工具开发的基础。Cas9作为基因编辑领域的明星蛋白,属于II型CRISPR-Cas系统效应蛋白,其可在guide RNA的引导下对目标双链DNA实现特异性地顺式切割,是目前最常使用的基因编辑工具。Cas9作为多核酸酶结构域的蛋白,可能有潜在的新核酸酶活性尚未被挖掘。
团队成员在研究中发现,target DNA激活了Cas9-sgRNA的反式切割活性。但该系统所表现出的反式切割活性较弱,一定程度上影响了Cas9-sgRNA系统在后续核酸检测方面的应用。而后团队成员采用了Cas9-tracrRNA-crRNA系统对Cas9的反式切割活性进行检测。结果表明,在双引导RNA系统(tracrRNA-crRNA)的协助下,Cas9的反式切割活性得到了显著提升:不仅对poly T/C/A分子均展现出了反式切割活性,还可在目标核酸分子存在的情况下对M13噬菌体基因组ssDNA分子实现非特异切割。团队成员进一步获得了Cas9-sgRNA-target RNA三元复合物的晶体结构,通过结构研究揭示了Cas9系统靶向目标RNA的原子基础。
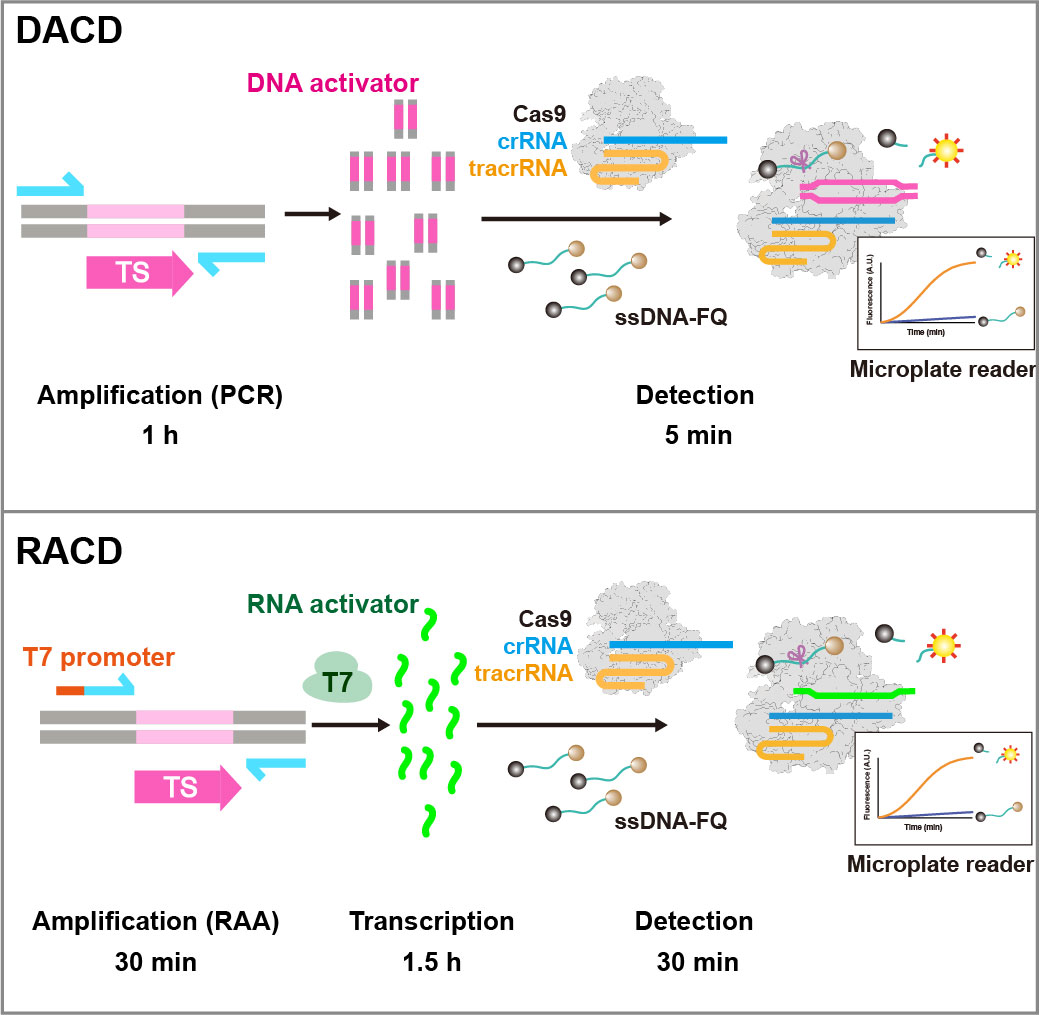
基于Cas9上述新活性,刘亮团队结合核酸扩增技术开发了两款名为DACD(DNA-activated Cas9 Detection)和RACD(RNA-activated Cas9 Detection)的核酸检测工具。采用该检测平台,团队实现了对猴痘病毒、呼吸道合胞病毒的高特异性、高灵敏度的快速检测。同时,Cas9-tracrRNA-crRNA系统在单核苷酸多态性检测中表现出了很强的特异性。在选取的靶序列仅存在单核苷酸差异的情况下,DACD和RACD法均可准确区分来自猴痘病毒刚果毒株和西非毒株的B6R基因。
综上,该研究证实了Cas9存在新的核酸酶活性,并拓展了Cas9除基因编辑工具以外的应用,同时为基因编辑提供了一定的指导作用,将进一步推进CRISPR检测在分子诊断领域的发展。
生命科学学院刘亮教授为该论文的通讯作者,助理教授陈霁云、2022级博士研究生陈莹、2021级博士研究生黄玲珑为该论文的共同第一作者,博士研究生林晓峰、陈泓、相文文参与了该论文的研究。该研究得到华中农业大学生命科学技术学院韩文元教授的大力支持,厦门大学生物医学仪器共享平台吴彩明、吴雅颖以及生命科学学院实验教学中心郑伟、胡进为该研究提供了重要的技术支持。该研究得到了国家自然科学基金、福建省自然科学基金、厦门市自然科学基金、厦门大学高层次人才启动经费等经费的资助。
论文链接:https://www.nature.com/articles/s41587-024-02255-7
(生命科学学院刘亮教授课题组)


