12月12日,我校李顺祥教授、中药学博士生段彦参与的中国药科大学肖易倍教授团队牵头的CRISPR-Cas调控ATP消耗抗病毒机制研究,以湖南中医药大学作为论文合作单位,在国际著名期刊Science(中科院一区TOP,IF:44.7)上发表题为Antiviral signaling of a type III CRISPR-associated deaminase的文章。

原核生物已经进化出了多种防御病毒感染的防御策略,如通过CRISPR-Cas(Clustered regularly interspaced short palindromic repeats and associated proteins)系统降解外源核酸和通过核苷酸池消耗抑制DNA/RNA合成。该研究阐明了一种III型CRISPR系统通过生成环化腺苷第二信使激活下游效应脱氨酶来耗竭ATP,从而实现免疫的分子机制。
该研究首先通过生物信息学分析挖掘到一类III型CRISPR-Cas下游缺失了广泛分布的核酸酶模块,取而代之的是一个融合了第二信使识别结构域的脱氨酶CAAD(CRISPR-Cas-associated adenosine deaminase),以及一个可能降解核苷的Nudix水解酶。表明该类系统的作用机制可能完全不同于已知的通过切割核酸实现免疫的CRISPR-Cas系统。然后通过体外重组,成功纯化得到了负责识别外源核酸的Cmr复合物。接下来利用MALDI-TOF技术证明该效应复合物通过互补配对识别外源核酸后,会利用ATP生成cA3/cA4/cA6三种环化腺苷。为确认第二信使,测定了不同环化腺苷对CAAD脱氨酶的亲和力,发现cA4和cA6均与CAAD有着极高的亲和力,而cA3几乎不会和CAAD结合。出乎意料的是,生化分析表明在该系统中,cA4和cA6均能高效激活CAAD的脱氨酶活性,并特异性地将ATP转化成ITP。进一步的生化实验证明CAAD下游的NH酶可特异性地将ITP降解成IMP,减少ITP的蓄积导致的细胞毒性,发挥解毒功能。最后通过体内实验验证了该类III型CRISPR-Cas系统在Cmr复合物以及CAAD-NH的协同作用下,可以抑制被外源核酸侵扰细菌的生长,达到群体免疫的作用。
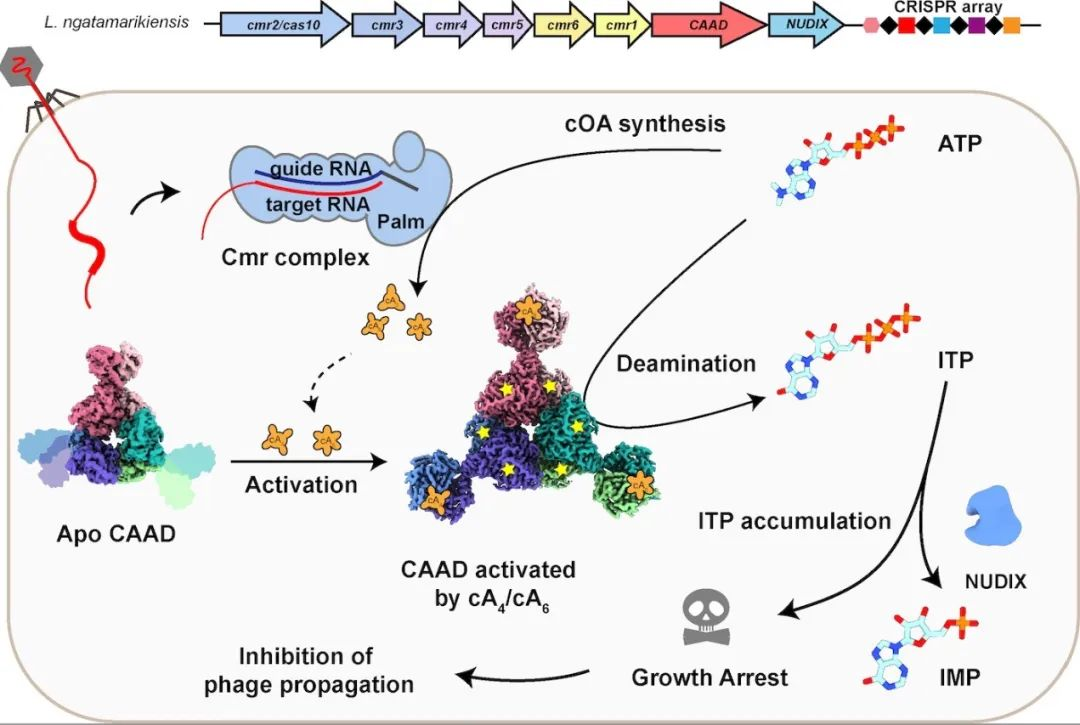
为进一步解释CAAD被第二信使的激活机制,利用冷冻电镜技术捕捉到了CAAD从无活性到被激活过程中一系列的高分辨率三维结构,直接观察到并证实了其激活过程中存在协同效应。CAAD由N端的CARF结构域和C端的脱氨酶结构域组成,依靠其互作界面形成一个由三个CAAD二聚体组成的六聚体复合物。当CARF未结合第二信使时,该结构域呈现出高度柔性可变状态,一旦CARF结合环化腺苷后,会发生60°旋转,让整个六聚体结构更紧凑的同时,带动脱氨酶结构域产生一系列构象变化,最终激活脱氨酶活性中心。
该研究发现了CRISPR核酸免疫系统中一条全新的核苷代谢-免疫调控-抗病毒通路,拓展了对III型CRISPR系统抗病毒免疫的机制的理解和认识,对效应蛋白CAAD脱氨酶作用机制的阐明为改造利用该免疫机制奠定了理论基础。
责编:闫丽颖
一审:闫丽颖
二审:彭莫凡
三审:廖娟







